|
 ความคิดเห็นที่ 51
ความคิดเห็นที่ 51 |
 |
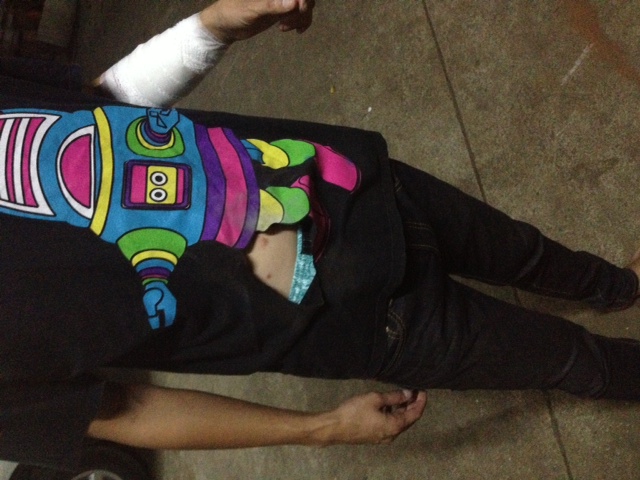
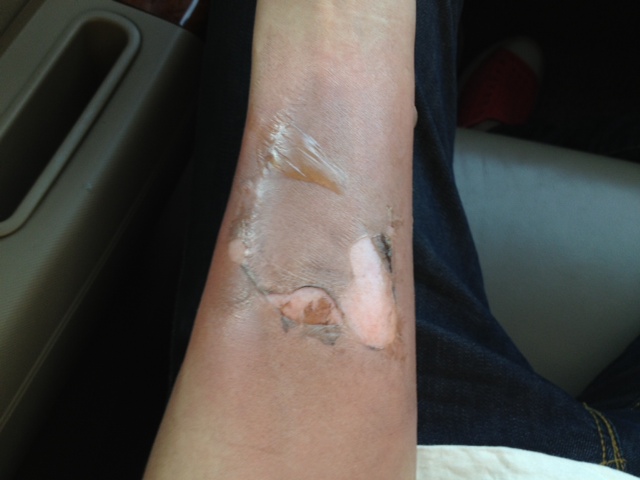
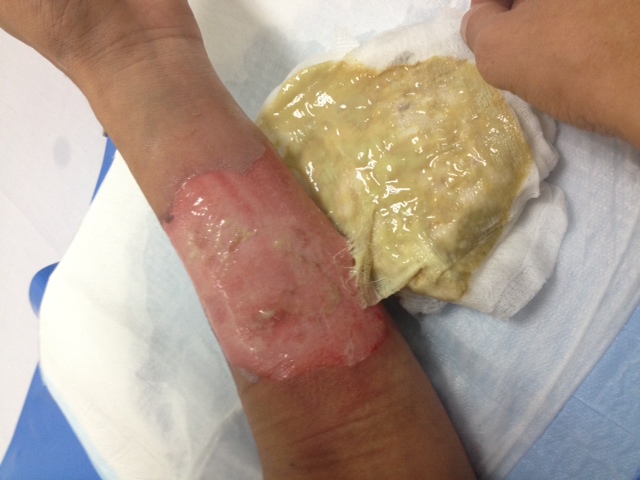
มันเป็นสารประกอบที่สามารถสร้างแกสได้ในระยะเวลาสั้นมากเป็น microseconds เพื่อตอบสนองการชนที่รุนแรงอย่างรวดเร็ว เพราะถ้าช้าหน้าจะฟาดพวงมาลัย
หลักการคล้ายการจุดระเบิดของดินปืนในกระสุน แต่กระสุนจะจุดชนวนที่แก๊ปท้ายปลอกกระสุน เมื่อเข็มแทงชนวนกระทบแก๊ปเกิดประกายไฟจุดดินปืนเกิดแกสขับดันหัวกระสุนออกจากปลอก
ส่วนแอร์แบคจุดชนวนด้วยไฟฟ้าจาก เซนเซอร์ ดังนั้นจึงใช้สารเคมีที่เหมาะกับการจุดระเบิดด้วยไฟฟ้าและที่สำคัญต้องเสถียรพอ ในการออกแบบด้านวิศวกรรม ผู้ออกแบบต้องออกแบบมาป้องกันเรื่องการระเบิดแล้วส่งผลให้เกิดบาดแผลต่อผู้ขับขี่หรือผู้โดยสาร เชื่อว่าน่าจะมีการผิดพลาดของตัวแอร์แบคจึงเกิดบากแผลขึ้นนะ
Older airbag systems contained a mixture of sodium azide (NaN3), KNO3, and SiO2. A typical driver-side airbag contains approximately 50-80 g of NaN3, with the larger passenger-side airbag containing about 250 g. Within about 40 milliseconds of impact, all these components react in three separate reactions that produce nitrogen gas. The reactions, in order, are as follows.
(1) 2 NaN3 → 2 Na + 3 N2 (g)
(2) 10 Na + 2 KNO3 → K2O + 5 Na2O + N2 (g)
(3) K2O + Na2O + 2 SiO2 → K2O3Si + Na2O3Si (silicate glass)
The first reaction is the decomposition of NaN3 under high temperature conditions using an electric impulse. This impulse generates to 300°C temperatures required for the decomposition of the NaN3 which produces Na metal and N2 gas. Since Na metal is highly reactive, the KNO3 and SiO2 react and remove it, in turn producing more N2 gas. The second reaction shows just that. The reason that KNO3 is used rather than something like NaNO3 is because it is less hygroscopic. It is very important that the materials used in this reaction are not hygroscopic because absorbed moisture can de-sensitize the system and cause the reaction to fail. The final reaction is used to eliminate the K2O and Na2O produced in the previous reactions because the first-period metal oxides are highly reactive. These products react with SiO2 to produce a silicate glass which is a harmless and stable compound.
According to a patent, the particle size of the sodium azide, potassium nitrate, and silicon dioxide are important. The NaN3 and KNO3 must be between 10 and 20 microns, while the SiO2 must be between 5 and 10 microns.
There has been a recent effort to find alternative compounds that can be used in airbags which have less toxic byproducts. In a journal article by Akiyoshi et. Al., it was found that for the reaction of the Sr complex nitrate, (Sr(NH2NHCONHNH2)∙(NO3)2 of carbohydrazide (SrCDH) with various oxidizing agents resulted in the evolution of N2 and CO2 gases. Using KBrO3 as the oxidizing agent resulted in the most vigorous reaction as well as the lowest initial temperature of reaction. The N2 and CO2 gases evolved made up 99% of all gases evolved. Nearly all the starting materials won’t decompose until reaching temperatures of 500°C or higher so this could be a viable option as an air bag gas generator. In a patent containing another plausible alternative to NaN3 driven airbags, the gas generating materials involved the use of guanidine nitrate, 5-amino tetrazole, bitetrazole dehydrate, nitroimidazole, and basic copper nitrate. It was found that these non-azide reagents allowed for a less toxic, lower combustion temperature reaction and more easily disposable air bag inflation system.
http://en.wikipedia.org/wiki/Airbag
| จากคุณ |
:
TNT
|
| เขียนเมื่อ |
:
18 พ.ย. 55 11:23:43
A:113.53.25.52 X: TicketID:375625
|
|
|
|
 |